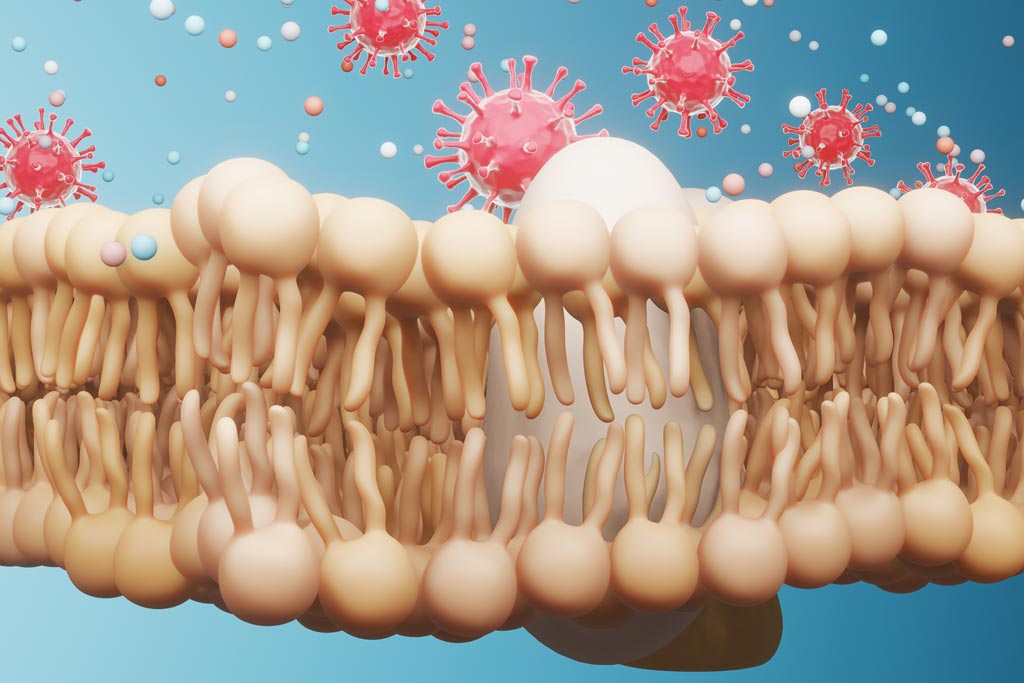
Los ácidos grasos juegan diversas funciones en todas las células, son importantes como fuente de energía y como componentes estructurales de la membrana celular. Cada tipo de ácido graso influye de una determinada manera en las propiedades físicas y funcionales de las membranas celulares, en las moléculas de señalización y en las moléculas reguladoras de la expresión génica1.
Se ha realizado una investigación documental con palabras clave como fatty acids, essential fatty acids, polyunsatured fatty acids, PUFA and coronavirus, COVID-19, SARS, MERS, SDRA, upper respiratory tract infection utilizando las principales fuentes y bases de datos biomédicas: Pubmed, Medline, The Cochrane Library, Google Scholar.
Los resultados de la búsqueda muestran que los ácidos grasos más reportados son:
- ácido gamma-linolénico (GLA, n-6)
- ácido araquidónico (AA, n-6)
- ácido eicosapentaenoico (EPA, n-3)
- ácido docosahexaenoico (DHA, n-3)
AG y la primera barrera de defensa
Los ácidos grasos esenciales (AGE) y sus metabolitos (lípidos bioactivos) tienen un papel crucial en la defensa de la piel, de las mucosas y superficies de tejidos2,3,4.
Varios AGE y AGPICL como GLA, AA, EPA y DHA inactivan a bacterias, virus y parásitos. Esta actividad parece ser debida a la destrucción de su cubierta/pared5.
Factores de riesgo y COVID-19
La obesidad, la hiperglucemia, la hipertensión, el dímero D y la ferritina elevada son cuatro de los factores de riesgo más importantes y son predictores de mortalidad6.
Tanto la obesidad como la hiperglucemia (prediabetes o diabetes mellitus tipo 2 poco controlada) son situaciones de inflamación crónica de bajo grado7,8.
OBESIDAD: producción de citoquinas proinflamatorias y resistencia a la leptina. Secuestra en el tejido adiposo vitaminas liposolubles como la vit D y vit A. Se genera hipoxia e isquemia en los tejidos9,10.
HIPERGLUCEMIA: en el 51% de los casos por SARS-CoV2 se observa hiperglucemia11 porque parece ser que el virus afecta a la célula pancreática. Esta situación puede verse agravada por el uso de glucocorticoides12.
Ácidos grasos n-3
Los ácidos grasos omega 3 pueden ejercer efectos beneficiosos en varias patologías con base inflamatoria13.
Controlar la respuesta inflamatoria local y sistémica en la COVID-19 puede ser tan importante como realizar terapias con antivirales. El EPA y DHA presentes en el sitio de inflamación son convertidos enzimáticamente a mediadores especializados pro-resolución (SPM) conocidos como resolvinas, protectinas y maresinas. Estos SPM ayudan a resolver la inflamación y evitar que se cronifique.
Los SPM y sus precursores lipídicos exhiben actividad antiviral en la influenza sin ser inmunosupresores. Actúan como moduladores de la inflamación14.
Las resolvinas también atenúan la trombosis y promueven la eliminación del coágulo, que está emergiendo como una patología clave de la infección por COVID-1915. Por lo tanto, los SPM pueden promover la resolución de la inflamación en COVID-19, reduciendo así el SDRA y otras complicaciones potencialmente mortales asociadas16.
Una de las complicaciones en la COVID 19 es el síndrome de activación macrofágica, que hace que los macrófagos sean constantemente proinflamatorios y lesivos (fenotipo M1). Los AGE n-3 ayudan a polarizar los macrófagos del fenotipo M1 a M2. El fenotipo M2 tiene una actividad antiinflamatoria y reparadora de los tejidos. En el estadio 3 de la enfermedad nos interesa que haya menor proporción de M1 y más M217,18.
Se ha demostrado en modelos animales que los SPM formados a partir del EPA y DHA protegen contra la lesión pulmonar aguda y SDRA, ayudando a resolver la inflamación y evitar la fibrosis consecuente (en este último caso solo el DHA)19.
Las deficiencias nutricionales en estos ácidos grasos esenciales y semiesenciales pueden provocar una resolución tardía o subóptima de la inflamación20.
Ácidos grasos n-6
La introducción de estrategias de suplementación con GLA para el alivio sintomático de la dermatitis atópica/eccema fue precedida históricamente por el uso de dosis diarias relativamente grandes de ácido linoleico oral (LA) procedentes de aceites vegetales. Esto se basó en la premisa de que los pacientes con dermatitis/eccema atópico tenían signos cutáneos distintivos de deficiencia de ácidos grasos esenciales. Estos pacientes presentaban un deterioro en la biosíntesis de los AGPI en una etapa temprana de la enzima FADS2 (Δ-6 desaturasa). Por ello se planteó la hipótesis de que los complementos de aceites vegetales con GLA podrían restaurar los AGPI y AGPICL necesarios y mitigar las patologías21,22.
Varios estudios también han investigado los efectos de GLA cuando se administra en combinación con AGPI omega-3 de origen marino. Preparados de nutrición enteral enriquecidos con aceites marinos que contienen AGPICL n-3 (EPA y DHA) junto con GLA han demostrado reducir la producción de citoquinas y el reclutamiento de neutrófilos en el pulmón, lo que resulta en menos días ventilación y estancias más cortas en la unidad de cuidados intensivos en pacientes con lesión pulmonar aguda o síndrome de dificultad respiratoria aguda23,24,25. Es importante destacar que estas combinaciones dietéticas también demostraron que reducen tanto la morbilidad como la mortalidad de pacientes críticos.
El DGLA y sus metabolitos han sido reconocidos por sus potentes efectos inhibitorios sobre la agregación de plaquetas y la inflamación. El impacto del DGLA en la agregación plaquetaria se reconoció por primera vez a principios de la década de 197026, donde Lagarde y sus compañeros demostraron que se necesitaban diez veces más colágeno y el doble de trombina para obtener la agregación cuando las plaquetas y las células endoteliales fueron tratadas previamente con DGLA en comparación con las plaquetas y las células endoteliales no tratadas27. Curiosamente, el DGLA fue mucho más potente que el EPA para inhibir la agregación plaquetaria28.
Los efectos antiinflamatorios del DGLA se han atribuido tanto a las propiedades antiinflamatorias de los metabolitos derivados del DGLA como a la capacidad del DGLA para competir con AA en la síntesis de productos de AA proinflamatorios29,30.
En las infecciones víricas humanas aparecen asociadas a niveles reducidos de metabolitos de LA, causados por la inhibición de la actividad de la Delta-6-desaturasa. En consecuencia, se ven a su vez reducidos los niveles de GLA con su prostaglandina antiinflamatoria. Además, el GLA junto con el EPA, presentan una acción antiviral directa contra virus con envolturas lipídicas31. Posiblemente actúen sinérgicamente con el interferón y otros agentes antivíricos. La administración de GLA junto con EPA ha mostrado resultados positivos en el tratamiento de la fatiga por síndrome post-viral32.
Actualmente hay varios estudios clínicos con suplementación con ácidos grasos poliinsaturados omega 3 y/o omega 6 (GLA):
- Anti-inflammatory/Antioxidant Oral Nutrition Supplementation on the Cytokine Storm and Progression of COVID-19: A Randomized Controlled Trial (ONSCOVID19): suplementación con 1,1 g EPA, 450 mg DHA, 950 mg GLA, 2840 IU vitamina A como 1,2 mg β-caroteno, 205 mg vitamina C, 75 IU vitamina E, 18 ug selenio, y 5.7 mg zinc. (14.8 g proteína, 22.2 g grasa, 25 g carbohidrato, 355 kcal/100g) (NCT04323228).
- Kerecis Oral and Nasal Spray for Treating the Symptoms of COVID-19 (KONS-COVID-19). Producto sanitario clase I. Spray nasal y oral con omega 3 procedente del aceite de Nemm e hipérico. Para los síntomas de la COVID como tos, irritación de garganta, disnea, hipogeusia, ageusia. NCT04357990
- A Randomized Controlled Study of Eicosapentaenoic Acid (EPA-FFA) Gastro-resistant Capsules to Treat Hospitalized Subjects With Confirmed SARS-CoV-2EPA-FFA to Treat Hospitalised Patients With COVID-19 (SARS-CoV-2). Suplementación con cápsulas gastrorresistentes de 500 mg de EPA. El modo de empleo son dos cápsulas dos veces al día (NCT04335032).
DESCARGAR EL MONOGRÁFICO COMPLETO

Protocolo micronutricional
Los productos que el Laboratorio LCN recomienda son los siguientes:
CN Base: Vitamina A, Vitamina C, Vitamina D3, Vitamina E, Vitamina B1, Vitamina B2, Vitamina B3, Vitamina B5, Vitamina B6, Vitamina B12, Biotina, Folatos, Zinc, Cobre, Manganeso, Molibdeno, Selenio, Magnesio, Cromo, Coenzima Q10 y Ácido R-lipoico.
Petit CN Base: Vitamina A, Vitamina C, Vitamina D3, Vitamina E, Vitamina B1, Vitamina B2, Vitamina B3, Vitamina B5 ,Vitamina B6, Folatos, Vitamina B12, Biotina, Zinc, Cobre, Manganeso, Calcio, Magnesio, Hierro, Molibdeno, Selenio, Yoduro, Cromo, Colina, Saccharomyces boulardii y Fructooligosacáridos de cadena corta (scFOS).
InmunoRespir: Vitamina A, Vitamina C, Zinc, N-Acetilcisteína y Quercetina.
Metabolic Pur: Vitamina C, Vitamina B1, Vitamina B2, Vitamina B3, Vitamina B5, Vitamina B6, Vitamina B9, Vitamina B12, Cromo, Magnesio, Ácido alfa R-lipoico, Glicina y N-Acetilcisteína.
ADULTOS
Prevención:
- CN Base: 2-0-0 durante las comidas
- InmunoRespir: 3-0-3 más de 20 minutos antes de las comidas (después de 1 mes o en épocas de baja exposición seguir con 2-0-2)
Si se presentan síntomas, aumentar a:
- CN Base: 2-0-0 durante las comidas
- InmunoRespir: 3-3-3 más de 20 minutos antes de las comidas
- Metabolic Pur: 1-1-0 más de 20 minutos antes de las comidas
Post-infección:
- CN Base: 2-0-0 durante las comidas
- InmunoRespir: 3-0-3 más de 20 minutos antes de las comidas
- Metabolic Pur: 1-0-0 más de 20 minutos antes de las comidas
Seguir durante unos meses para evitar las secuelas de la infección.
Si la persona tiene patologías o factores de riesgo como exceso de peso, elevada hemoglobina glicosilada, glucemia, ferritina y/o fibrinógeno, hipertensión arterial, cardiopatía, patología respiratoria, esteatosis hepática, insuficiencia renal, neuropatías, etc. Añadir:
- Omega Base: 2-0-0 con las comidas
En personas de edad avanzada o con comorbilidades, consulte con su Delegado Comercial del Laboratorio LCN o contacte con info@laboratoriolcn.com
NIÑOS
Niños de 4 a 8 años:
Refuerzo:
- Petit CN Base: 1-0-0
- InmunoRespir: 2-0-0
Cuando hay síntomas
- Petit CN Base: 1-0-0
- InmunoRespir: 1-1-1
Niños de 9 a 17 años:
Refuerzo:
- Petit CN Base: 1-0-0
- InmunoRespir: 2-0-2
Cuando hay síntomas
- Petit CN Base: 1-0-0
- InmunoRespir: 2-2-2
Si ya se está tomando cualquier otro producto de La Micronutrición Básica se puede seguir con la misma pauta. Los micronutrientes que se incluyen en La Micronutrición Básica están formulados para trabajar en conjunto, sin presentar contraindicaciones ni efectos secundarios y actúan dentro de los parámetros de la micronutrición óptima.
La información contenida está destinada a profesionales de la salud, con el objetivo de proporcionarles información científica sobre micronutrientes y salud. Es responsabilidad del profesional de la salud evaluar y contrastar la información proporcionada en cuanto a su posible uso y relevancia en la práctica profesional.
Referencias bibliográficas
1 – Calder PC & Burdge GC (2004) Fatty acids. In Bioactive Lipids, pp. 1– 36 [A Nicolaou and G Kokotos, editors]. Bridgewater: The Oily Press
2 – Park NH, Choi JS, Hwang SY, Kim YC, Hong YK, Cho KK, Choi IS. Antimicrobial activities of stearidonic and gamma-linolenic acids from the green seaweed Enteromorpha linza against several oral pathogenic bacteria. Bot Stud. 2013 Dec;54(1):39.
3 – Kohn A, Gitelman J, Inbar M. Unsaturated free fatty acids inactivate animal enveloped viruses. Arch Virol 1980;66:301e306.
4 – Horowitz B, Pi€et MP, Prince AM, et al. Inactivation of lipid-enveloped viruses in labile blood derivatives by unsaturated fatty acids. Vox Sang 1988;54:14e20
5 – Knapp HR, Melly MA. Bactericidal effects of polyunsaturated fatty acids. J Infect Dis. 1986 Jul;154(1):84-94.
6 – Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020;395:507e13
7 – Ilias I, Zabuliene L. Hyperglycemia and the novel Covid-19 infection: possiblepathophysiologic mechanisms. Med Hypotheses 2020;139. 109699
8 – Divella R, De Luca R, Abbate I, Naglieri E, Daniele A. Obesity and cancer: the role of adipose tissue and adipo-cytokines-induced chronic inflammation. J Canc 2016;7:2346e59
9 – Michalakis K, Venihaki M, Mantzoros C, Vazaiou A, Ilias I, Gryparis A, et al. In prostate cancer, low adiponectin levels are not associated with insulin resistance. Eur J Clin Invest 2015;45:572e8
10 – Ellulu MS, Patimah I, Khaza’ai H, Rahmat A, Abed Y. Obesity and inflammation: the linking mechanism and the complications. Arch Med Sci 2017;13:851e63
11 – Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020;395:507e13
12 – Saigí I, Pérez A, Hiperglucemia inducida por glucocorticoids Semin Fund Esp Reumatol. 2011; 12(3) :83–90
13 – Calder, P. C. Marine omega-3 fatty acids and inflammatory processes: effects, mechanisms and clinical relevance. Biochim. Biophys. Acta 1851, 469–484 (2015).
14 – Tam, V. C., Quehenberger, O., Oshansky, C. M., Suen, R., Armando, A. M., Treuting, P. M., Thomas, P. G., Dennis, E. A., & Aderem, A. (2013). Lipidomic profiling of influenza infection identifies mediators that induce and resolve inflammation. Cell, 154(1), 213–227.
15 – Cherpokova, D., Jouvene, C. C., Libreros, S., DeRoo, E. P., Chu, L., de la Rosa, X., Norris, P. C., Wagner, D. D., & Serh, C. N. (2019). Resolvin D4 attenuates the severity of pathological thrombosis in mice. Blood 134 (17), 1458–1468.
16 – Panigrahy D, Gilligan MM, Huang S, Gartung A, Cortés-Puch I, Sime PJ, Phipps RP, Serhan CN, Hammock BD. Inflammation resolution: a dual-pronged approach to averting cytokine storms in COVID-19? Cancer Metastasis Rev. 2020 May 8.
17 – Kawano A, Ariyoshi W, Yoshioka Y, Hikiji H, Nishihara T, Okinaga T. Docosahexaenoic acid enhances M2 macrophage polarization via the p38 signaling pathway and autophagy. J Cell Biochem. 2019 Aug;120(8):12604-12617
18 – Williams-Bey Y, Boularan C, Vural A, Huang NN, Hwang IY, Shan-Shi C, Kehrl JH. Omega-3 free fatty acids suppress macrophage inflammasome activation by inhibiting NF-κB activation and enhancing autophagy. PLoS One. 2014 Jun 9;9(6):e97957.
19 – Gao, Y.; Zhang, H.; Luo, L.; Lin, J.; Li, D.; Zheng, S.; Huang, H.; Yan, S.; Yang, J.; Hao, Y.; et al. Resolvin D1 improves the resolution of inflammation via activating NF-_B p50/p50–mediated cyclooxygenase-2 expression in acute respiratory distress syndrome. J. Immunol. 2017, 199, 2043–2054.
20 – Basil, M.C.; Levy, B.D. Specialized pro-resolving mediators: Endogenous regulators of infection and inflammation. Nat. Rev. Immunol. 2016, 16, 51–67.
21 – Burr, G.O., Burr, M.M., 1929. A new deficiency disease produced by the ridid exclusion of fat from the diet. J Biol Chem 82, 345-367.
22 – Burr, G.O., et al., 1932. On the fatty acids essential in nutrition. III. J Biol Chem 97, 1-9.
23 – Gadek, J.E., et al., 1999. Effect of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in patients with acute respiratory distress syndrome. Crit Care Med 27, 1409-1420.
24 – Pontes-Arruda, et al., 2006. Effects of enteral feeding with eicosapentaenoic acid, γ-linolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock. Crit Care Med 34, 2325-2333
25 – Singer, P., et al., 2006. Benefit of an enteral diet enriched with eicosapentaenoic acid and gamma-linolenic acid in ventilated patients with acute lung injury. Crit Care Med 34, 1033-1038.
26 – Willis, A.L., et al., 1974 . Dihomo-gamma-linolenate suppresses platelet aggregation when administered in vitro or in vivo. Prostaglandins 8, 509-519.
27 – Lagarde, M., et al., 1981. Human platelet PGE1 and dihomogammalinolenic acid. Comparison to PGE2 and arachidonic acid. Prog Lipid Res 20, 439-443.
28 – Lagarde, M., et al., 1981. Human platelet PGE1 and dihomogammalinolenic acid. Comparison to PGE2 and arachidonic acid. Prog Lipid Res 20,439-443.
29 – Chilton-Lopez, T., et al., 1996. Metabolism of gammalinolenic acid in human neutrophils. J Immunol 156, 2941-2947.
30 – Levin, G., et al., 2002. Differential metabolism of dihomo-γ-linolenic acid and arachidonic acid by cyclo-oxygenase-1 and cyclo-oxygenase-2: implications for cellular synthesis of prostaglandin E1 and prostaglandin E2. Biochem J 365, 489-496.
31 – Horowitz B, Piët MP, Prince AM, Edwards CA, Lippin A, Walakovits LA. Inactivation of lipid-enveloped viruses in labile blood derivatives by unsaturated fatty acids. Vox Sang. 1988;54(1):14‐20.
32 – Pullman-Mooar S, Laposata M, Lem D, et al. Alteration of the cellular fatty acid profile and the production of eicosanoids in human monocytes by gamma-linolenic acid. Arthritis Rheum. 1990;33(10):1526‐1533.